
Figura1: Vista esquemática de um átomo.
A maior parte
da massa do átomo está concentrada no núcleo,
que é pequeno e muito denso.
de
Química Orgânica I
Faculdade de Filosofia, ciências e letras
habilitação em química
Professor Hamilton M. Viana
4. ano A/C
1999
I) INTRODUÇÃO *
a) Observações Gerais *
Provas *
Trabalhos *
MAS DEVO "DECORAR" MUITAS COISAS ? *
COMO DEVO ESTUDAR Química Orgânica ? *
c) O modelo de LEWIS para ligações *
C2) formação das ligações químicas *
C3) Eletronegatividade e ligações químicas *
C4) Desenhando a estruturas de Lewis para íons e moléculas covalentes *
C5) carga formal *
V) Ressonância *
b) Setas Curvas e Movimentação de Elétrons *
As aulas serão ministradas às sextas-feiras .das 7h30min às 11h05min para a turma do 4o ano A, e às sextas-feiras das 19h15min às 22h50min para a turma do 4o ano C.
As provas serão em número de 3 (três)
1 no primeiro bimestre
1 no terceiro bimestre
1 no quarto bimestre
Obs.: Todas as provas contemplarão TODA a matéria discutida/apresentada, inclusive o conteúdo dos trabalhos, atividades e experiências em laboratório.
Exceto os trabalhos/atividades realizados em sala de aula, todos os demais deverão ser DIGITADOS (ou datilografados).
Uma atenção especial deve ser dada à informação dos componentes do grupo. Nomes acrescentados à lista de componentes com letra manuscrita, após a conclusão da mesma, bem como duplicidade de nomes em trabalhos de grupos diferentes, implicarão na anulação de ambos trabalhos e na conseqüente atribuição da nota ZERO, a ambos os trabalhos.
Listas de Exercícios e laboratório
As listas de exercícios serão retiradas na home page de orgânica1 e deverão ser resolvidas e entregues em até 15 dias. A entrega, em princípio é individual, mas é interessante que todos tentem resolver os exercícios pois isso é um estudo !
b) O Estudo
O entendimento da Química Orgânica (suas reações, as propriedades de seus compostos, etc.) necessita do conhecimento da eletronegatividade, da geometria (forma) das moléculas, da intensidade das ligações, etc.
A Química Orgânica é o ramo da Química onde o maior número de interações com os demais ramos acontece.
MAS DEVO "DECORAR" MUITAS COISAS ?
Segundo o "Aurélio", cor, vem do latim, significa coração; portanto saber alguma coisa "de cor" significa que esta informação, essa característica de uma pessoa já está registrada em nosso coração!
O sentido do "de cor" acabou sofrendo alguma atualização em seu sentido e passou a significar "memorizado".
Antes mesmo de iniciarmos o estudo da Química Orgânica, vale desmistificar alguns "fantasmas" nascidos no decorrer dos anos.
Qualquer ramo do conhecimento, exige um mínimo de memorização !
Como você poderia jogar xadrez, se não memorizasse as formas, os nomes e os movimentos das peças ?
Como poderíamos estar lendo este texto se não tivéssemos memorizado as letras, e depois disso, entendido como se formam as palavras ?
Os exemplos são numerosos, e o objetivo não é esgotá-los, mas sim, mostrar que seremos quase que obrigados a memorizar algumas coisas para então podermos entender outras mais complexas e até fazermos algumas extrapolações.
Concluindo: Não poderemos trabalhar os compostos orgânicos se não soubermos os seus nomes ! (Ou você pode ter um relacionamento com qualquer pessoa se não souber seu nome ?).
COMO DEVO ESTUDAR Química Orgânica ?
Não existe um método universal para o estudo.
Algumas pessoas estudam em grupo, estudam ouvindo música, estudam escrevendo, enfim, não existe uma maneira milagrosa, do tipo "Aprenda Química Orgânica em 12 horas" ! Todo aprendizado requer dedicação, e principalmente no início do estudo, devemos nos empenhar muito para que a Nomenclatura dos compostos orgânicos tenha sido aprendida e esteja sempre pronta para ser usada.
Muitos de vocês devem ter percebido que ao "preparar uma cola", no momento de usá-la, conseguem lembrar de tudo o que foi escrito! Isto é um método de estudar :
Muitos cursinhos pré-vestibular utilizam essa ferramenta para orientar o estudo dos seus alunos :
Sem esforço, não se aprende muita coisa !
Não é novidade, mas a Química Orgânica exige uma dedicação grande, constante!
Para os curiosos no tema, seguem algumas referências
para aprofundamento:
MAGRO, Marina Celeste, Estudar também de aprende, São Paulo, Editora Pedagógica e Universitária Ltda., 1979.
FERNANDES, N. M.; Técnicas de Estudo (Como Estudar sozinho); São Paulo, Editora Pedagógica e Universitária Ltda.; 1988
HOFFBECK, G.; WALTER, J.; Como tomar notas rapidamente...e bem.; São Paulo; Livraria Nobel S. A.; 1991.
BIGGE, M. L. ; Teorias da Aprendizagem Para Professores;
São Paulo; Editora Pedagógica e Universitária Ltda.;
1977.
Você deve estar familiarizado com os fundamentos da estrutura eletrônica dos átomos. Um átomo pode ser assim representado:

Figura1: Vista esquemática de um átomo.
A maior parte
da massa do átomo está concentrada no núcleo,
que é pequeno e muito denso.

x = 2n2, onde x é o número máximo de elétrons
n é o nível energético
Os níveis energéticos são divididos em subníveis que são representados pelas letras s, p, d e f e os elétrons estão alocados dentro dos subníveis, nos orbitais.


Regra 1 : Os orbitais são preenchidos em ordem crescente de energia, do menos energético para o mais energético.
Regra 2 : Cada orbital pode hospedar um numero máximo de 2 elétrons.
Regra 3 : Quando 2 orbitais de energia equivalente estiverem disponíveis mas não existirem elétrons suficientes para completá-los, um elétron deve ser adicionado a cada um dos orbitais e caso existam elétrons suficientes, um orbital hospedará o segundo elétron.
Regra 4 : Um orbital só pode hospedar 2 elétrons se os spins desses elétrons forem opostos.
Fazer os exercícios da lista L1QOIv99
Ao discutir as propriedades físicas e químicas dos elementos, os químicos freqüentemente enfocam a camada mais externa ou o nível mais energéticos, pois esse nível que estão os elétrons de valência, que são os elétrons envolvidos nas reações químicas.
Para mostrar os elétrons de valência, usamos a representação desenvolvida por Gilbert N. Lewis. (1875 – 1946), chamada de ESTRUTURA DE LEWIS.
A estrutura de Lewis mostra o símbolo químico do elemento, rodeado por um número de pontos (ou cruzes) igual ao número de elétrons no nível mais energético desse átomo.

c) O modelo de LEWIS para ligações
Em 1946 Lewis desenvolveu um modelo bastante simples que unificou muitas das observações sobre ligações químicas e reações dos elementos. Segundo ele, a baixíssima reatividade dos gases nobres indicava um alto grau de estabilidade na configuração eletrônica desses elementos : hélio com 2 elétrons na camada de valência (1s2), o neônio com 8 elétrons na camada de valência (2s22p6), e o argônio com 8 elétrons na camada de valência (3s23p6). A tendência dos átomos reagirem para atingir uma camada de valência com 8 elétrons é particularmente comum nos elementos dos grupos 1A a 7A e recebe o nome especial de Regra do Octeto.
Fazer os Exercícios da Lista L2QOIv99
C2) formação das ligações químicas
Uma ligação química acontece entre 2 átomos de uma forma que ambos adquiram a configuração de um gás nobre. Os átomos podem adquirir a configuração de um gás nobre de 2 maneiras :
Uma maneira de estimar a extensão do caráter covalente ou iônico de uma ligação química é comparar a eletronegatividade dos átomos envolvidos. Eletronegatividade é a medida da força de atração de um átomo para elétrons que eles compartilham numa ligação química com outro átomo. A escala de eletronegatividade mais amplamente divulgada foi desenvolvida por Linus Pauling (1901 – 1994) nos anos 1930.

Na escala de Pauling, o flúor é o elemento
mais eletronegativo, com um valor de eletronegatividade igual a 4.0 e os
outros elementos têm sua eletronegatividade determinada em função
da eletronegatividade do flúor.
Porem a eletronegatividade de um elemento não
depende apenas da posição desse elemento na tabela periódica,
mas também do seu estado de oxidação. A eletronegatividade
do Cu(I) no Cu2O, p. ex., é 1.8, ao passo que a eletronegatividade
do Cu(II) no CuO é 2.0.
Apesar dessas variações, a eletronegatividade
é um guia muito útil para a distribuição dos
elétrons na ligação química.
Podemos classificar as ligações químicas
de acordo com a diferença de eletronegatividade dos átomos
envolvidos na ligação .

Fazer exercícios da Lista L3QOIv99
C4) Desenhando a estruturas de Lewis para íons e moléculas covalentes
A habilidade para escrever as estruturas de Lewis para moléculas covalentes e íons é fundamental para o estudo da Química Orgânica .As seguintes diretrizes irão ajudar :

Fazer os Exercícios da Lista L4QOIv99
No decorrer do curso não serão trabalhadas apenas moléculas, mas também cátions e ânions poliatômicos. Dentre os exemplos mais comuns temos o cátion hidrônio (H3O+), o cátion amônio (NH4+) e o ânion bicarbonato (HCO3-).
É importante poder determinar qual átomo ou quais átomos no íon poliatômico apresentam a carga positiva ou a carga negativa. A carga do átomo no íon é chamada de carga formal. Para determinar a carga formal, devemos :
| Número de | Total de | Metade de | ||||||
| Carga |
|
Valência no |
|
Elétrons |
|
Todos os | ||
| Formal | Átomo | Não ligantes | Elétrons | |||||
| neutro | ligantes |
Fazer os Exercícios da Lista L5QOIv99
IV) Ângulos das ligações e forma das moléculas.
Para um perfeito entendimento da teoria envolvida nas formas das moléculas precisamos recorrer à Teoria de Lewis e também ao modelo de Repulsão Par Eletrônico – Camada de Valência (VSEPR – sigla em inglês). De acordo como modelo VSEPR, o átomo é rodeado por uma camada de elétrons de valência. Esses elétrons de valência podem estar envolvidas na formação de ligações simples, duplas ou triplas, ou podem estar na forma de elétrons não ligantes. Cada uma desses combinações cria uma região negativa no espaço, e devido à repulsão de uma região pela outra, as várias regiões de densidade eletrônica ao redor do átomo se espalham para ficar o mais distante possível das demais.
As figuras seguintes mostram algumas moléculas e suas disposições espaciais.
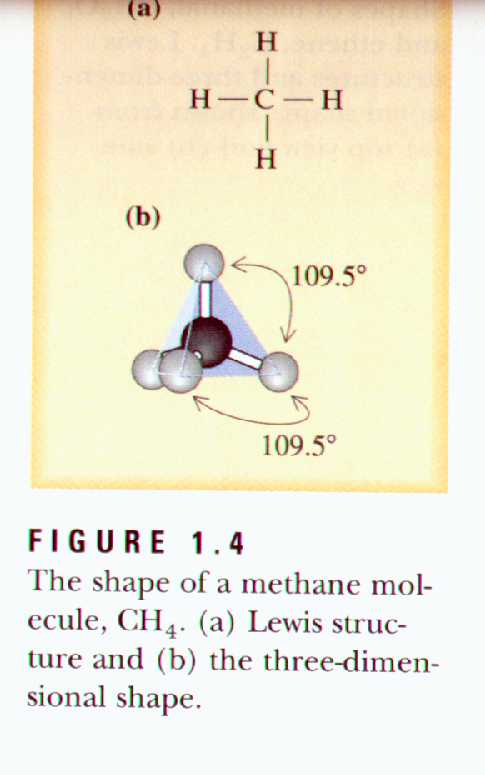




Fazer os exercícios da LISTA
L6QOIv99
Como os químicos desenvolveram estruturas complexas com as ligações covalentes, é óbvio que para um grande número de moléculas e íons, uma estrutura de Lewis simples não seja suficiente para uma representação real. A figura seguinte mostra 3 estruturas de Lewis para o íon carbonato.

Para descrever o íon carbonato, bem como outras moléculas e íons para os quais, estruturas simples de Lewis não são adequadas, fazemos então uso da teoria da ressonância.
De acordo com a teoria da Ressonância, muitas moléculas e íons são melhor descritos escrevendo-se duas ou mais estruturas de Lewis e considerando-se a molécula real ou íon como sendo uma composição dessas estruturas. As estruturas individuais de Lewis são chamadas estruturas de contribuição.
Pode-se demonstrar que uma molécula real ou íon é um híbrido de várias estruturas de contribuição por interconexão de todas com setas de duplo sentido. As estruturas de contribuição para o carbonato são mostradas a seguir :

Essas regras devem ser seguidas para escrever estruturas de contribuição aceitáveis :
b) Setas Curvas e Movimentação de Elétrons
Perceba na figura 1.10 apenas uma alteração das estrutura (a) para (b) e então de (b) para (c) têm-se apenas uma redistribuição dos elétrons de valência. Para mostrar essa redistribuição, os químicos usam um símbolo chamado seta curvada.
Uma seta curvada mostra o reposicionamento de um par de elétrons da sua origem (o início da seta) para seu destino (a ponta da seta). Futuramente, os elétrons em movimento irão auxiliá-lo a visualizar as etapas de ruptura e de formação nas reações orgânicas. É uma via de sobrevivência na Química Orgânica .
Fazer os Exercícios da Lista L7QOIv99
Por mais que os modelos de Lewis e de VSEPR tenham auxiliado no entendimento das ligações covalentes e na geometria das moléculas, esses modelos deixam algumas questões sem resposta. A mais importante destas questões é a relação entre estrutura molecular e reatividade química. Por exemplo, as ligações duplas carbono-carbono são bem diferentes em reatividade química das ligações simples carbono-carbono. A maioria das ligações carbono-carbono é pouco reativa, mas as ligações duplas reagem com uma grande variedade de reagentes. O modelo de Lewis não nos permite quantificar essas diferenças, então vamos utilizar um novo modelo de ligação covalente por sobreposição de orbitais atômicos.
a) Formação de ligação covalente por sobreposição de orbitais atômicos.
De acordo com o modelo de ligação de valência, uma ligação covalente é formada quando uma porção do orbital atômico de um átomo se sobrepõe a uma porção de um orbital atômico de um outro átomo. Na formação da ligação covalente no H2, p. ex., dois hidrogênios se aproximam para que o orbital 1s de cada um deles se sobreponha para formar uma ligação covalente sigma (s ).

Uma ligação (s
) sigma é uma ligação covalente na qual cada
orbital sobreposto da ligação é concentrado ao longo
do eixo que une os dois núcleos.

A formação de uma ligação covalente entre dois hidrogênios é frontal. A formação de ligação covalente com os elementos do segundo período, apresenta um novo problema. Na formação das ligações covalentes, átomos de carbono, nitrogênio e oxigênio (elementos do segundo período), usam orbitais atômicos 2s e 2p. os três orbitais atômicos 2p (2px, 2py e 2pz) estão dispostos com ângulos de 90o de afastamento (fig. 1.3), e se átomos do segundo período usam esses orbitais para formar ligações covalentes, os ângulos das ligações ao redor de cada um deles pode ser aproximadamente 90º. Contudo, ângulos de ligação de 90o raramente são encontrados em moléculas orgânicas. Ao invés disso, encontramos ângulos de ligações de aproximadamente 109.5o nas moléculas com apenas ligações simples, 120º em moléculas com uma ligação dupla e 180º em moléculas com ligação tripla.

Para quantificar os ângulos observados nestas ligações, Linus Pauling propôs que os orbitais atômicos se combinavam para formar novos orbitais, chamados de orbitais atômicos híbridos, ou simplesmente, orbitais híbridos, que então interagem para formar ligações com os ângulos observados. Existem três tipos de orbitais híbridos, designados sp3, sp2 e sp; e cada um deles pode comportar um máximo de 2 elétrons. Veremos como esses orbitais são formados e suas características.
c) orbitais híbridos sp3 – Ângulos de ligação de aproximadamente 109.5o
A combinação de um orbital atômico 2s e três orbitais atômicos 2p forma 4 orbitais equivalentes, orbitais híbridos sp3 ocorrem sempre em grupos de quatro. Cada orbital híbrido sp3 consiste de um lobo largo apontando para uma direção e um lobo menor apontando na direção oposta. Os eixos dos 4 orbitais híbirdos estao apontados em direção aos vértices de um tetraedro regular, e a hibridização sp3 resulta em ângulos de aproximadamente 109.5º .

Você deve se lembrar que os expoentes na designação dos orbitais híbridos indicam quantos orbitais se combinaram para formar os orbitais híbridos.
d) orbitais híbridos sp2 – Ângulos de ligação de aproximadamente 120o
A combinação de um orbital atômico 2s e dois orbitais atômicos 2p forma 3 orbitais equivalentes, orbitais híbridos sp2 ocorrem sempre em grupos de três. Cada orbital híbrido sp2 consiste de um lobo largo apontando para uma direção e um lobo menor apontando na direção oposta. Os eixos dos 3 orbitais híbridos estão sobre o mesmo plano e estão apontados em direção aos vértices de um triângulo equilátero, e a hibridização sp2 resulta em ângulos de aproximadamente 120º. O terceiro orbital atômico não se envolve na hibridização e consiste de dois lobos situados no plano perpendicular ao plano dos orbitais híbridos sp2.
Os elementos do segundo período usam os orbitais híbridos para formar ligações duplas. Considerem o eteno, C2H4, cuja estrutura é mostrada na figura 1.15 (a). uma ligação sigma é formada pela sobreposição de dois orbitais híbridos sp2 sobre um eixo comum, conforme mostrado na figura 1.15 (b). cada carbono forma ainda duas ligações sigma com dois hidrogênios. O orbital 2p remanescente de cada um dos carbonos, está paralelo ao outro orbital 2p remanescente do outro carbono e eles se sobrepõem, formando uma ligação pi (p ), conforme a figura 1.15 (c).
 Figura
1.15 : (a) 1 orbital sp2; (b) disposição espacial
dos três orbitais sp2 ; (c) disposição espacial
do orbital "P" remanescente
Figura
1.15 : (a) 1 orbital sp2; (b) disposição espacial
dos três orbitais sp2 ; (c) disposição espacial
do orbital "P" remanescente
A aproximação de ligações
de valência descrevem todas as ligações duplas da mesma
maneira que foi descrita a ligação dupla carbono-carbono
. no metanal, CH2=O, a molécula orgânica mais simples
que contém uma ligação dupla carbono-oxigênio,
o carbono forma ligações s com
dois hidrogênios pela sobreposição do orbital sp2 do
carbono e um orbital atômico 1s dos hidrogênios. Carbono e
oxigênio são ligados por uma ligação formada
pela sobreposição dos orbitais híbridos sp2 e uma
ligação p é formada pela
sobreposição de dois orbitais não hibridizados ("puros")
2p.
e) orbitais híbridos sp – Ângulos de ligação de aproximadamente 180o
A combinação de um orbital atômico 2s e um orbital atômicos 2p forma 2 orbitais equivalentes, orbitais híbridos sp ocorrem sempre em grupos de dois. Os dois orbitais híbridos sp estão dispostos num ângulo de 180º em relação ao núcleo. Os eixos dos orbitais atômicos 2p não hibridizados são perpendiculares entre si e em relação ao eixo dos dois orbitais híbridos sp.


