

Me lo contaron y lo olvidé, lo vi y lo entendí, lo hice y lo
aprendí.
Confucio
![]()
Una tira de papel, una regla, un objeto cilíndrico, por ejemplo, una lata de refresco.
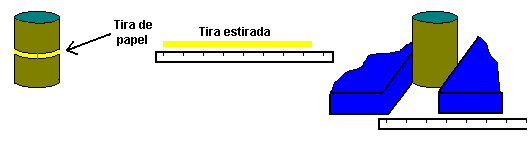
La relación entre la longitud de una circunferencia de radio r (2![]() r) y su diametro (2r) es
r) y su diametro (2r) es ![]()
![]()
Georges Louis Leclerc(1707-88), Conde de Buffon fue un celebre
naturalista francés autor de una monumental Historia Natural en 44 tomos que recopilaba
el conocimiento científico con un fin eminentemente divulgativo. Hoy en dia su nombre
aparece muchas veces asociado a un problema denominado "La aguja de Buffon" que
relaciona el número pi con el lanzamiento de una aguja sobre una superficie rayada.
Buffon demostro que si lanzamos, al azar, una aguja de longitud L sobre una
superficie en la que hay dibujadas líneas paralelas separadas una distancia D, la
probabilidad de que la aguja corte a una línea es :
![]()

Aquí tienes dos programas para simular el experimento de la aguja de Buffon en tu ordenador :
Si quieres calcular varios millones de cifras de pi en muy poco tiempo, aquí tienes un programa hecho en el Laboratorio Kanada de la Universidad de Tokio por los mismos(D. Takahashi & Y. Kanada) que tienen el record actual de cifras de Pi (52.000.000.000) :
Si quieres conocer unas cuantas cifras de Pi
Si quieres saber un poco más sobre el número Pi: el número ![]()
![]() En palabras de Evangelista
Torricelli(1608-1647) vivimos en el fondo de un mar de aire. Sobre cada una de nuestras
cabezas tenemos aproximadamente 2 toneladas de aire que ejercen una presión de
101300 N/m2.
En palabras de Evangelista
Torricelli(1608-1647) vivimos en el fondo de un mar de aire. Sobre cada una de nuestras
cabezas tenemos aproximadamente 2 toneladas de aire que ejercen una presión de
101300 N/m2.
![]() ¿Cómo es posible que no notemos semejante
presión?
¿Cómo es posible que no notemos semejante
presión?
![]() La respuesta es que todo nuestro interior está
también a esa misma presión. Si en un momento dado todo el aire de la atmósfera
desapareciera de la Tierra, literalmenre explotaríamos debido a la presión de nuestro
interior que no estaría contrarrestada.
La respuesta es que todo nuestro interior está
también a esa misma presión. Si en un momento dado todo el aire de la atmósfera
desapareciera de la Tierra, literalmenre explotaríamos debido a la presión de nuestro
interior que no estaría contrarrestada.
![]() Aunque en la superficie de la Tierra todo está
sometido a la presión del aire, es posible concebir experiencias que la pongan de
manifiesto :
Aunque en la superficie de la Tierra todo está
sometido a la presión del aire, es posible concebir experiencias que la pongan de
manifiesto :
 |
|
 |
|
 |
Vamos a utilizar esta técnica para separar los pigmentos utilizados en una tinta comercial.
Material necesario
- Una tira de papel poroso. Se puede utilizar el papel de filtro de una cafetera o incluso recortar el extremo (sin tinta) de una hoja de periódico.
- Rotuladores o bolígrafos de distintos colores.
- Un vaso
- Un poco de alcohol
Prodecimiento
- Recorta una tira del papel poroso que tenga unos 4 cm de ancho y que sea un poco mas larga que la altura del vaso.
- Enrrolla un extremo en un bolígrafo(puedes ayudarte de cinta adhesiva) de tal manera que el otro extremo llegue al fondo del vaso. (ver dibujo)
- Dibuja una mancha con un rotulador negro en el extremo libre de la tira, a unos 2 cm del borde. Procura que sea intensa y que no ocupe mucho. (ver dibujo)
- Echa en el fondo del vaso alcohol, hasta una altura de 1 cm aproximadamente.
- Sitúa la tira dentro del vaso de tal manera que el extremo quede sumergido en el alcohol pero la mancha que has hecho sobre ella quede fuera de él.
- Puedes tapar el vaso para evitar que el alcohol se evapore.
- Observa lo que ocurre : a medida que el alcohol va ascendiendo a lo largo de la tira, arrastra consigo los diversas pigmentos que contiene la mancha de tinta. Como no todos son arrastrados con la misma velocidad, al cabo de un rato se ven franjas de colores.
- Repite la experiencia utilizando diferentes tintas.
- Pide a un amigo que sostenga una regla tal como se indica en la figura y que la deje caer sin avisarte.
- Sitúa tus dedos sobre el cero y cuando veas que la suelta, cierra los dedos sobre ella.
- Anota la distancia que ha caído la regla. Vendrá indicada por la división que se encuentre debajo de tus dedos.
- Repítelo varias veces hasta que obtengas valores similares
La distancia que ha caído la regla depende de tu tiempo de reacción.
Si no se tiene en cuenta el rozamiento con el aire, un cuerpo que cae libremente, partiendo del reposo, recorre una distancia vertical que viene dada por :
| d : distancia recorrida | |
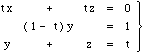 |
g : aceleración de la gravedad (9,8 m/s2) |
| t : tiempo que dura la caída |
Distancia Recorrida (cm) Tiempo de Reacción (s) 5 0,10 10 0,14 15 0,18 20 0,20 25 0,23 30 0,25
Introduce uno de los dos valores y haz click FUERA de la casilla
- Llena dos vasos con agua
- Añádele a uno de ellos sal poco a poco. Revolviendo con una cuchara, trata de disolver la mayor cantidad posible. En un vaso de 200 cm3 se pueden disolver unos 70 g de sal.
- Coloca el huevo en el vaso que tiene solo agua : se irá al fondo.
- Colócalo ahora en el vaso en el que has disuelto la sal : observarás como queda flotando.
- Pon el huevo y agua hasta que lo cubra y un poco más, en el tercer vaso. Añade agua con sal, de la que ya tienes, hasta que consigas que el huevo quede entre dos aguas(ni flota ni se hunde).
- Si añades en este momento un poco de agua, observarás que se hunde. Si a continuación añades un poco del agua salada, lo verás flotar de nuevo. Si vuelves añadir agua, otra vez se hundirá y así sucesivamente.
[Adaptado de Snyder, (1995)]
Los ácidos y bases son dos tipos de sustancias que de una manera sencilla se pueden
caracterizar por las propiedades que manifiestan.
Los ácidos :
Las bases :
| NOTA DE SEGURIDAD NO PRUEBES ningún ácido o base a no ser que tengas la absoluta certeza de que es inócuo. Algunos ácidos pueden producir quemaduras muy graves. Es peligroso incluso comprobar el tacto jabonoso de algunas bases. Pueden producir quemaduras. |
En la tabla que sigue aparecen algunos ácidos y bases corrientes :
| ácido o base | donde se encuentra |
| ácido acético | vinagre |
| ácido acetil salicílico | aspirina |
| ácido ascórbico | vitamina C |
| ácido cítrico | zumo de cítricos |
| ácido clorhídrico | sal fumante para limpieza, jugos gástricos |
| ácido sulfúrico | baterías de coches |
| amoníaco (base) | limpiadores caseros |
| hidróxido de magnesio (base) | leche de magnesia (laxante y antiácido) |
Los químicos usan el pH para indicar de forma precisa la acidez o basicidad de una sustancia. Normalmente oscila entre los valores de 0 (más ácido) y 14 (más básico). En la tabla siguiente aparece el valor del pH para algunas sustancias comunes.
| sustancia | pH |
| jugos gástricos | 2,0 |
| limones | 2,3 |
| vinagre | 2,9 |
| refrescos | 3,0 |
| vino | 3,5 |
| naranjas | 3,5 |
| tomates | 4,2 |
| lluvia ácida | 5,6 |
| orina humana | 6,0 |
| leche de vaca | 6,4 |
| saliva (reposo) | 6,6 |
| agua pura | 7,0 |
| saliva (al comer) | 7,2 |
| sangre humana | 7,4 |
| huevos frescos | 7,8 |
| agua de mar | 8,0 |
| disolución saturada de bicarbonato sódico |
8,4 |
| pasta de dientes | 9,9 |
| leche de magnesia | 10,5 |
| amoníaco casero | 11,5 |
Los indicadores son colorantes orgánicos, que cambian de color según estén en
presencia de una sustancia ácida, o básica.
Las lombardas, parecidas a repollos y de color violeta,contienen en sus hojas un
indicador que pertenece a un tipo de sustancias orgánicas denominadas antocianinas.
Para extraerlo :
Las características del indicador obtenido son :
| color que adquiere | medio en el que está |
| rosa o rojo |
ácido |
| azul oscuro |
neutro |
| verde |
básico |
| NOTA DE SEGURIDAD El amoníaco es un VENENO. Identifica adecuadamente el recipiente que lo contiene. NO lo pruebes y NO lo dejes en un sitio donde alguien pudiera probarlo por error. |
Dale a alguien un vaso que contiene un poco de agua con extracto de lombarda y unas
gotas de amoniaco casero y pídele que sople a través de una pajita de refresco. Puedes
presentarlo como un test de alcohol, mal aliento, etc. La disolución pasará de color
verde esmeralda a azul oscuro. Si ahora le añades vinagre, la disolución adquirirá un
color rojo.
Al soplar expulsamos dióxido de carbono (CO2) que en contacto con el agua
forma ácido carbónico (H2CO3). Este ácido formado, neutraliza el
amoníaco que contiene la disolución. Al añadir vinagre la solución adquiere un pH
ácido
Impregna una tira de papel de cocina en una disolución del extracto de lombarda. Acerca una cerilla inmediatamente después de encenderla. Se observa que aparece un punto rojo (ácido) en la tira de papel.
¿A qué se debe ? ¿Puede ser debido al dióxido de carbono (CO2) generado en la combustión ? No, la disolución formada (ácido carbónico) no es suficientemente ácida como para producir el color rojo. (Se puede comprobar repitiendo el experimento pero dejando arder la cerilla un poco antes de acercarla al papel). La causa de la aparición del color rojo está en el dióxido de azufre (SO2) que se forma cuando la cerilla se inflama. Esto se debe a la presencia de azufre(S) añadido, entre otros productos, a la cabeza de la cerilla, para favorecer la ignición.
El dióxido de azufre en contacto con el agua presente en la tira de papel forma ácido sulfuroso (H2SO3) que es más ácido que el ácido carbónico
.
En la combustión de algunos derivados del petroleo se produce dióxido de azufre
que pasa a la atmósfera. Al llover y entrar en contacto con el agua, se forma el ácido
sulfuroso , uno de los responsables de la lluvia ácida.